 |
1. Explica por qué el estado líquido es el más característico de la materia viva. |
| |
El estado líquido es el más característico de la materia viva, debido a que el agua es el componente mayoritario de todos los seres vivos.
En ella se encuentran, en disolución o en suspensión, prácticamente todos los demás componentes, formando los llamados sistemas dispersos. En éstos, la fase dispersante es el agua y la fase dispersa puede ser cualquiera de las demás moléculas.
|
 |
2. ¿Qué ocurriría si se colocaran en agua marina glóbulos rojos de la sangre? ¿Y si fuesen células vegetales? Razona la respuesta. |
| |
|
Si se coloca un glóbulo rojo en una solución hipertónica, como es el agua marina, el citoplasma del glóbulo rojo perderá agua, la célula se deshidratará, se contraerá y morirá. |
En el caso de las células vegetales también se produce una deshidratación que hace que la membrana plasmática se separe de la pared celular, lo que produce la rotura de la célula. |
 |
|
 |
3. El pH del plasma sanguíneo de una persona sana es generalmente de 7,4. No obstante, en una diabetes severa puede disminuir hasta 6,8, e incluso ser menor. Calcula la relación de protones del plasma de una persona diabética respecto al de una persona normal. |
| |
el pH = - log 10 [H + ] |
| por lo tanto: |
en el plasma de una persona normal |
|
| mientras que en una persona diabética |
|
| de donde se deduce que: |
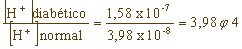
Es decir, la concentración de protones en un diabético es unas cuatro veces superior a la de una persona normal.
|
|
 |
4. Un remedio habitual para paliar el hipo consiste en aumentar la concentración de CO2 en los pulmones y, como consecuencia, en la sangre. Esto se consigue aguantando la respiración o por exhalación e inhalación de aire en una bolsa. Explica el efecto de estos métodos sobre el pH de la sangre, teniendo en cuenta la presencia en ésta del tampón bicarbonato. |
| |
El pH de la sangre está controlado por el sistema tampón dióxido de carbono/bicarbonato, cuya ecuación neta es:
Al contener la respiración aumenta la concentración de CO2 en los pulmones y, consecuentemente, también aumenta en la sangre arterial. Este incremento desplaza el equilibrio de la reacción hacia la derecha, aumentando la concentración de H +, o sea, disminuyendo el pH.
|
 |
5.En el libro de texto se muestra la estructura de la D-ribulosa, una importante cetopentosa de las plantas. ¿Cuántos carbonos asimétricos contiene esta cetopentosa? ¿Cuál es la estructura de las demás cetopentosas? Identifica cada una de ellas como D o L. Explica las respuestas. |
| |
Las cetopentosas poseen dos carbonos asimétricos: los carbonos 3 y 4.
Si el OH del carbono 3 se sitúa |
Si el OH del carbono 4 se sitúa |
a la derecha,
se llama ribulosa |
a la izquierda
se llama xilulosa |
a la derecha
pertenece a la serie D |
a la izquierda
pertenece a la serie L |
|
|
|
|
|
 |
6. El enlace hemiacetal de la glucosa se está formando y rompiendo continuamente, con lo que el carbono anomérico manifiesta las características de un grupo carbonilo. La adición de glucosa a disoluciones alcalinas de ion Ag + (ensayo de Tollen) hace que su grupo carbonilo libre (es decir, que no está implicado en un enlace O-glucosídico) sea oxidado por el ion Ag + , el cuál se reduce a plata metálica y se deposita en las paredes del tubo de ensayo, convirtiéndolo en un espejo.
• Una muestra desconocida está compuesta, bien por lactosa, bien por sacarosa. Cuando se somete la muestra al ensayo de Tollen, el resultado es negativo, es decir, no se produce el espejo de plata. ¿Es lactosa o es sacarosa? Explícalo.
• Se obtiene un resultado positivo con el ensayo de Tollen si la muestra anterior, previamente, se somete a hidrólisis (tratándola con una disolución diluida de un ácido y calentándola). ¿Por qué?
|
| |
a) Un ensayo de Tollen negativo indica que la muestra no posee grupos carbonilo libres (o, lo que es lo mismo, que no posee carbonos anoméricos libres. Como la lactosa sí posee un carbono anomérico libre (el de la glucosa) y la sacarosa no (tanto el carbono anomérico de la glucosa como el de la fructosa participan en el enlace O-glucosídico), la muestra ha de estar constituida por sacarosa.
b) Al ser sometida a hidrólisis, se rompe el enlace O-glucosídico y la glucosa liberada presenta un grupo carbonilo libre que da una respuesta positiva al ensayo de Tollen.
|
 |
7. Tanto la celulosa como la amilosa consisten en unidades de D-glucosa unidas por enlaces O-glucosídicos entre los carbonos 1 y 4, y ambas pueden estar extensamente hidratadas. A pesar de esta semejanza, cuando la dieta de una persona consiste principalmente en amilosa (almidón) se engorda, mientras que cuando consiste en celulosa (madera) se puede morir de hambre. ¿ Por qué ? |
| |
A pesar de las notables semejanzas entre la celulosa y la amilosa, hay una diferencia importante:
los enlaces (1 4) de la celulosa se encuentran en configuración ß , mientras que en la amilosa se 4) de la celulosa se encuentran en configuración ß , mientras que en la amilosa se
encuentran en configuración a. Esta diferencia es reconocida por las enzimas intestinales humanas, que son incapaces de hidrolizar los enlaces de la celulosa, por lo que ésta no puede utilizarse como fuente de alimentación.
|
 |
8. ¿ Qué ácido tendrá mayor punto de fusión: el esteárico ( ácido graso saturado de 18 átomos de carbono) o su correspondiente ácido graso insaturado, el ácido oleico? Razona la respuesta. |
| |
Cuanto más largas sean las cadenas de los ácidos grasos, mayor número de interacciones se establecen entre ellas (puentes de hidrógeno entre sus grupos carboxilo y fuerzas de Van der Waals entre los grupos metileno de sus cadenas alifáticas) y se requiere mayor cantidad de energía para deshacerlas; por lo que el punto de fusión de los ácidos grasos y de las grasas derivadas de ellos es más alto, y suelen aparecer en forma sólida o semisólida.
Cuando aumenta el grado de insaturación, las cadenas de ácidos grasos forman un acodamiento rígido en el espacio, haciendo que su empaquetamiento sea más irregular y las interacciones entre las cadenas más débiles. En este caso, se necesita menos energía para romper las uniones, el punto de fusión es más bajo y los ácidos grasos, o las grasas derivadas, son líquidos o con alto grado de fluidez. Por lo tanto, el ácido de mayor punto de fusión será el esteárico.
|
 |
9.Un triacilglicérido desconocido fue aislado a partir de aceite de oliva. La hidrólisis de la muestra produjo ácido palmítico y ácido oleico en una proporción de 1 a 2.
a) Representa las dos estructuras posibles del triacilglicérido compatibles con la información dada.
b) La disolución del triacilglicérido en un disolvente polar resultó ser ópticamente activa. ¿Cuál de las dos estructuras dibujadas corresponde al triacilglicérido desconocido?.
c) Una grasa está formada mayoritariamente por éste triglicérido. Razona en qué estado físico se encontraría a temperatura ambiente y si se trata de una grasa animal o vegetal.
|
| |
a) Las dos estructuras posibles son:
b) Como el triacilglicérido desconocido es ópticamente activo, debe poseer al menos un carbono asimétrico.
Analizando las posibles estructuras, se observa:
Estructura A |
Estructura B |
| Posee un carbono asimétrico en la posición 2, ya que los ácidos grasos unidos a las posiciones 1 y 3 son diferentes. |
No posee un carbono asimétrico en la posición 2, ya que los ácidos grasos unidos a las posiciones 1 y 3 son iguales. |
Por lo tanto el triacilglicérido desconocido debe tener la estructura A.
c) Se trata de una grasa en la que predominan dos ácidos grasos insaturados de cadena larga, las cuales tienden a separarse lateralmente, lo que dificulta la formación de enlaces de Van der Waals, por lo que se mantienen en estado líquido a temperatura ambiente. Esta característica es propia de las grasas vegetales.
|
 |
10. Un método común para limpiar la grasa acumulada en los sifones de los fregaderos consiste en verter por el desaqüe algún producto que contenga hidróxido de sodio. Explica cómo actúa. |
| |
Los triacilglicéridos presentes en las grasas animales son hidrolizados por el hidróxido de sodio en un proceso conocido como saponificación. Los productos de la saponificación son los jabones, que son mucho más solubles en el agua que los triacilglicéridos.
|
 |
11.Sabiendo que el punto isoeléctrico de la alanina es 6 indica la carga y estructura química que posee este aminoácido a pH 2 y a pH 9,0. ¿Cómo influyen los cambios de pH en la desnaturalización de las proteínas? |
| |
El punto isoeléctrico es el pH al que la molécula no posee carga neta.
|
 |
12.La tripsina es una enzima proteolítica que cataliza la hidrólisis de aquellos enlaces peptídicos en los que el grupo carboxilo es aportado por los aminoácidos lisina o arginina. La termolisina es otra enzima hidrolítica que cataliza la ruptura de los enlaces peptídicos en los que la función amino es aportada por los aminoácidos valina, leucina e isoleucina. Describe los productos de la hidrólisis del siguiente péptido por acción, en primer lugar, de la tripsina y a continuación de la termolisina:
H2N - Met - Lys - Glu - Val - Ala - Cys - Leu - Cys - Arg - Asp - lle - COOH |
|
| |
Por acción de la tripsina, y en presencia de agua, dará:
Met - Lys + Glu - Val - Ala - Cys - Leu - Cys - Arg + Asp - lle |
Posteriormente, por acción de la termolisina, y en presencia de agua, dará:
Met - Lys + Glu - Val - Ala - Cys + Leu - Cys - Arg + Asp + lle |
|
 |
13.Si una molécula de ADN posee un 30% de guanina, averigua en qué proporción se encuentran las restantes bases. |
| |
Citosina: 30%, Adenina: 20%, Timina: 20%, Uracilo: 0%
|
 |
14.Explica qué será más fácil de separar, las dos hebras de una molécula de ADN o los nucleótidos que componen cada hebra. |
| |
Las dos hebras de ADN serán más sencillas de separar debido a que están unidas por puentes de hidrógeno, enlaces muy débiles que se forman y rompen con gran facilidad; mientras que los nucleótidos de cada una de las hebras están unidos por enlaces covalentes mucho más fuertes que los de hidrógeno.
|
 |
15. En la siguiente tabla se representa el porcentaje de cada una de las bases del ADN en distintas especies
|
A |
G |
C |
T |
A/T |
G/C |
Humano |
30,9 |
19,9 |
19,8 |
29,4 |
|
|
Pollo |
28,8 |
20,5 |
21,5 |
29,2 |
|
|
Trigo |
27,3 |
22,7 |
22,8 |
27,1 |
|
|
Levadura |
31,3 |
18,7 |
17,1 |
32,9 |
|
|
Bacteria E.coli |
24,7 |
26,0 |
25,7 |
23,6 |
|
|
Virus T7 |
26,0 |
24,0 |
24,0 |
26,0 |
|
|
a) Completa la tabla calculando las relaciones A/T y G/C.
b}¿Qué conclusiones podemos sacar? ¿A qué son debidas esas equivalencias?
|
| |
a)
|
A |
G |
C |
T |
A/T |
G/C |
Humano |
30,9 |
19,9 |
19,8 |
29,4 |
1,05 |
1,01 |
Pollo |
28,8 |
20,5 |
21,5 |
29,2 |
0,98 |
0,95 |
Trigo |
27,3 |
22,7 |
22,8 |
27,1 |
1,01 |
0,99 |
Levadura |
31,3 |
18,7 |
17,1 |
32,9 |
0,95 |
1,09 |
Bacteria E.coli |
24,7 |
26,0 |
25,7 |
23,6 |
1,04 |
1,01 |
Virus T7 |
26,0 |
24,0 |
24,0 |
26,0 |
1 |
1 |
b) Las relaciones A/T y G/C dan, en todos los casos, una cifra próxima a la unidad.Se puede concluir que el número de bases de adenina es igual al de timina y el número de bases de guanina es igual al de citosina. Estas equivalencias se deben a que se trata, en todos los casos analizados, de un ADN bicatenario.
|
|